Ver más grande
Ver más grande
C.N. 983213
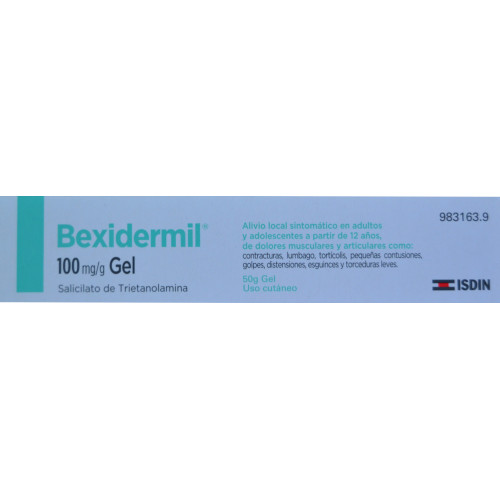
BEXIDERMIL 100 MG/ML SOLUCIÓN PARA PULVERIZACIÓN 200 ML ISDIN
Este producto ya no está disponible
Nuevo producto
- Escribe tu opinión
- Sacar de mis favoritos
- Agregar este producto a mis favoritos
Prospecto: información para el usuario
BEXIDERMIL 100 mg/ml solución para pulverización cutánea
Salicilato de trietanolamina
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento porque contiene información importante para usted.
Siga exactamente las instrucciones de administración del medicamento contenidas en este prospecto o las indicadas por su médico,o farmacéutico.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si necesita consejo o más información, consulte a su farmacéutico.
- Si experimenta efectos adversos, consulte a su médico, o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
- Debe consultar a un médico si empeora o si no mejora después de 7 días.
Contenido del prospecto:
- Qué es Bexidermil y para qué se utiliza
- Qué necesita saber antes de empezar a usar Bexidermil
- Cómo usar Bexidermil
- Posibles efectos adversos
- Conservación de Bexidermil 100 mg/ml solución para pulverización cutánea
- Contenido del envase e información adicional
1. Qué es Bexidermil y para qué se utiliza
Bexidermil es una solución para pulverización cutánea.
El salicilato de trietanolamina, principio activo de este medicamento, pertenece al grupo de los preparados cutáneos para el dolor de las articulaciones y los músculos.
Este medicamento está indicado en adultos y adolescentes a partir de 12 años para el alivio local sintomático de dolores musculares y articulares como:
- contracturas
- lumbago
- torticolis
- pequeñas contusiones, golpes, distensiones
- esguinces y torceduras leves;
- Debe consultar a un médico si empeora o si no mejora después de 7 días de tratamiento.
2. Qué necesita saberantes de empezar a usar Bexidermil
No use Bexidermil
- si es alérgico (hipersensible) al salicilato de trietanolamina o a alguno de los demás componentes de este medicamento (incluidos en la sección 6)
- sobre heridas abiertas, piel erosionada mucosas, ni en quemaduras
- si ha sufrido reacciones alérgicas (rinitis, asma, picor, dificultad para respirar, urticaria, shock u otras), provocadas por ácido acetilsalicílico u otros antiinflamatorios no esteroideos (como el ibuprofeno).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar Bexidermil 100 mg/ml solución para pulverización cutánea.
Antes de aplicar Bexidermil debe tener en cuenta:
- Este medicamento es para uso externo. No ingerir.
- aplicar solamente en la piel intacta. evitar el contacto con los ojos y las mucosas
- no utilizar vendajes oclusivos ni aplique calor en la zona donde lo use
- no utilizar en áreas extensas
- no debe aplicar Bexidermil en la misma zona en la que se hayan aplicado otros medicamento que contengan analgésicos tópicos
- por su contenido en etanol, la aplicación frecuente del medicamento puede producir irritación y sequedad de la piel
Niños
No se debe utilizar este medicamento en niños menores de 12 años.
Uso de otros medicamentos
Informe a su médico o farmacéutico si está tomando, o ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
No se debe aplicar en la misma zona otros productos similares.
Informe a su médico si está siendo tratado con anticoagulantes orales (como el acenocumarol y la warfarina). Su médico decidirá si puede utilizar el medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Las mujeres embarazadas o en periodo de lactancia no pueden utilizar este medicamento a no ser que su medico se lo recete por no haber encontrado otro medicamento más seguro y ser estrictamente necesario el tratamiento. En caso de utilización, limitar al mínimo la dosis y la duración del tratamiento.
Conducción y uso de máquinas
El uso de este medicamento no afecta a la capacidad para conducir y manejar máquinas.
3. Cómo usar Bexidermil
Siga exactamente las instrucciones de administración del medicamento contenidas en este prospecto o las indicadas por su médico o farmacéutico. En caso de duda, consulte a su médico o farmacéutico.
La dosis recomendada es: 1 pulverización de la solución en la zona dolorida o inflamada de 3 a 4 veces al día si fuera necesario.
Este medicamento es para uso cutáneo, exclusivamente sobre piel íntegra. No ingerir.
Debe realizarse la pulverización desde una distancia de unos 10 cm de la zona afectada. Su aplicación puede producir sensación de frío.
Lávese las manos después de cada aplicación.
No sobrepase la dosis recomendada de 3-4 aplicaciones al día
Debe consultar a un médico si empeora o si no mejora después de 7 días de tratamiento.
Uso en niños
Este medicamento es para uso en adolescentes mayores de 12 años.
Si usa más Bexidermil del que debe
Si usted se ha aplicado más Bexidermildel que debiera se pueden producir problemas en la piel.
Debido a que su uso es externo (sobre la piel), no es probable que se produzca intoxicación.
La ingestión accidental puede producir náuseas, vómitos, dolor abdominal, inquietud, somnolencia y vértigo. Los pacientes intoxicados con síntomas gastrointestinales o neurológicos graves deben ser observados y tratados sintomáticamente. No inducir el vómito.
En caso de ingestión accidental acuda inmediatamente a un centro médico o bien llame al Servicio de Información Toxicológica, Teléfono: 915 620 420 indicando el medicamento y la cantidad ingerida.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Durante el periodo de utilización del salicilato de trietanolamina se han notificado los siguientes efectos adversos cuya frecuencia no se ha podido establecer con exactitud: sensibilización cutánea o reacciones alérgicas cutáneas en la zona de aplicación que remiten al interrumpir el tratamiento.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano:www.notificaRAM.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Bexidermil 100 mg/ml Solución para pulverización cutánea
Mantener fuera del alcance y de la vista de los niños.
Líquido y vapores muy inflamables.
Mantener alejado del calor, de superficies calientes, de chispas, de llamas abiertas y de cualquier otra fuente de ignición. No fumar.
No utilice Bexidermil después de la fecha de caducidad que aparece en el envase.
La fecha de caducidad es el último día del mes que se indica.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el Punto SIGRE de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Bexidermil 100mg/ml solución para pulverización cutánea
El principio activo es salicilato de trietanolamina. Cada mililitro de Bexidermil contiene 100 mg de salicilato de trietanolamina.
Los demás componentes (excipientes) son: macrogolglicéridos de caprilocaproil, macrogol, mentol y etanol 99,5%.
Aspecto de producto y contenido del envase
Es un líquido transparente, incoloro o ligeramente amarillento, con suave olor a mentol.
Se presenta en frasco pulverizador de polietileno sin gas, con válvula difusora y tapón de poliestireno. Cada frasco contiene 200 ml de solución para pulverización cutánea.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización:
Isdin SA
Provençals, 33
08019 Barcelona
España
Responsable de la fabricación:
ESTEVE PHARMACEUTICALS, S.A.
C/ de Sant Martí, 75-97
08107 Martorelles (Barcelona)
España
Fecha de la última revisión de este prospecto: febrero del 2016
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es
Reseñas